全面质量管理(Total quality management,TQM)属于质量管理的里程碑。全面指的是对药品研发全工程的管理。全面质量管理的重点是设计为主,持续改进,同时以客户为中心,全面提高水平。在药品研发过程中,质量管理涉及的内容非常多。本文以索利那新原料药为例,采用液相和气相两种方式,分析药物质量控制要点。
1 关于索利那新的质量控制
索利那新是一种用于膀胱过度活动症患者,伴有的尿失禁和/或尿频、尿急症状的治疗的药物,在医疗市场获准治疗范围较广。对索利那新原料药的质量进行研究,可优化质量,保证产品的稳定。在原料药质量控制过程中,比较复杂的就是杂质的研究与控制。
1.1 索利那新原料药的杂质以及主要反应步骤
通常杂质引入的途径有以下几种途径:在生产工艺中引入(存在原因:原料不纯、原料反应不完全、副反应产生杂质);在贮存过程中引入(贮存过程中受到温度、湿度、光照、氧化等外因的干扰产生杂质)。在生产工艺中引入杂质需要从源头进行控制,按照合成线路的各个步骤使用的原料进行逐个分析。
关于索利那新原料药,反应步骤如下:
反应步骤:从1,2,3,4-四氢异喹啉合成得到中间体1,中间体1与R-奎宁醇合成得到中间体2,中间体2与结合生成成品索利那新。
主要原料:1,2,3,4-四氢异喹啉、R-3-奎宁醇,分别从性状、红外及液相保留时间鉴别、卡尔费休水分分析,及液相、气相及滴定法对含量、杂质、异构体、炽灼残渣分析等方面进行质量检测。四氢异喹啉要求总杂质不大于1.0%,其他单个最大杂质不大于0.3%,含量98.0%~102.0%,异构体杂质不大于0.5%。R-3-奎宁醇要求气相总杂质不大于1.0%,其他单个最大杂质不大于0.2%,通过滴定法进行含量控制,要求其含量不低于85%,异构体杂质不大于0.2%。
在合成过程中,通过高效液相色谱监测反应转化程度,控制反应液中原料1,2,3,4-四氢异喹啉的残留量不大于0.3%;工艺操作中设计了精制工序,以进一步去除杂质。
1.2 索利那新原料药质量控制体系以及标准的建立
结合工艺流程、药典以及国际法的要求,对于索利那新建立合理的质量控制体系,关于质量控制体系的建立标准,气、液相相关内容如表1。
表1 相关标准 导出到EXCEL
|
项目名称 |
标准 |
|
鉴别 |
(1)IR |
|
(2)HPLC |
|
水分 |
≤0.5% |
|
有关物质 |
HS026101≤0.15% |
|
HS026302≤0.15% |
|
其它单个杂质≤0.10% |
|
总杂质(除异构体、HS026201外)≤0.30% |
|
HS026201* |
≤0.015% |
|
异构体 |
HS026305≤0.15% |
|
HS026303≤0.15% |
|
HS026304≤0.15% |
|
含量(无水无残溶计) |
含C27H32N2O6应为98.0~102.0% |
|
(无水无残溶计) |
23.0~26.0% |
|
残留溶剂/ ppm |
异丙醇≤5000 |
|
叔丁醇≤5000 |
|
甲苯≤890 |
2 相关杂质检验分析
2.1 高效液相色谱法检验测试索利那新的杂质
高效液相色谱法的开发结合药典通则、生产工艺、药物特性(如HS026201为潜在基因毒性杂质,定为不大于0.015%的限度较低)等多种因素综合研究,通过带有紫外检测器的反相高效液相色谱检测索利那新的杂质。
试剂:乙腈、水、磷酸氢二钾、磷酸。
仪器:液相色谱仪;流动相过滤器;A级玻璃仪器,色谱柱:Waters RP18峰鉴别溶液:取HS026101、HS026302和索利那新各对照品适量,配制成各浓度约为0.5µg/mL、0.5µg/mL、0.5mg/mL的溶液。
对照溶液:取索利那新对照品适量,配制成浓度约2.5µg/ml的溶液。
样品溶液:取索利那新样品适量,配成浓度约0.5mg/mL的溶液,平行配制2份。
色谱条件:检测波长:210nm;流速:1.0mL/min;柱温:30℃;进样量:10µL。
采集时间:约2.5倍主峰保留时间。
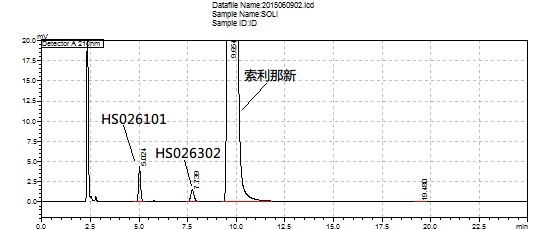
完成上述操作后,制备缓冲液,运行序列。系统适用性满足要求后,如图1,进样品溶液,按公式计算单个杂质、总杂质含量。
图1 峰鉴别溶液
每一个参数和标准都要进行验证。
采用信噪比的方法来计算理论定量限和检测限,确定方法的检测灵敏度。
配制0.015%样品浓度索利那新溶液、0.004%样品浓度的HS026101、0.010%样品浓度的HS026302,连续进样6次,信噪比在10~15之间,为定量限。将定量限溶液稀释约3倍,信噪比在2~5之间,为检测限。专属性方面,在没有其他峰干扰的情况下,通过分离度来评估其专属性,要求使HS026302与索利那新之间分离度≥3.0,则认为专属性符合要求。为了在精密度方面有很大的提升,需要配置6份相同的索利那新样品溶液(溶液A1、A2、A3、A4、A5和A6),并且进样;另一方面,配制6份加入已知杂质限度浓度的同一批索利那新样品溶液(溶液AC1、AC2、AC3、AC4、ACS和AC6),并且进样。
定量精密度:接受标准为各系列的6针进样结果的RSD不大于5%。加入已知杂质限度浓度精密度:溶液AC1、AC2、AC3、AC4、ACS和AC6中每个杂质的回收率:80%~120%,RSD不大于25%。
在线性关系方面,配制5份不同浓度水平的标准溶液,来评价方法的线性。杂质分别为限度浓度的400%、200%、100%、50%和25%。一方面,配制上述5个浓度水平的标准溶液(溶液B1、C1、D1、E1和F1)。另一方面,同样配制相同的份索利那新溶液,加入相应量的对照品(溶液BC1、CC1、DC1、EC1和FC1)。每个样品进一次。采用最小二乘法来计算包括对照液和加入标准的对照液系列的回归曲线来评价各溶剂量和峰面积的线性关系。线性的接受标准为:相关系数不小于0.99,截距百分比≤15.0%。
准确度验证方法:使用溶液AC1、AC2、AC3、CC1和DC1。计算实验浓度(通过代入相应回归曲线)和实际浓度的比值来计算溶液回收率。计算所有回收率的RSD。通过Student检验法来对准确度进行评价,以判断回收率是否接近100%,未接标准为:定量限RSD≤50%,回收率:50%~150%,其它点RSD≤25%,回收率:80%~120%。经过反复的计算,就可以得到相关的浓度范围,也能够确定好质量。
2.2 气相检测方式
所需要的仪器:气相色谱仪,FID检测器,顶空进样器。
使用的色谱柱为:DB-624毛细管色谱柱(30m×0.53mm×3µm)。
气相色谱法检测索利那新中的残留溶剂。检测灵敏度、线性、回收率、范围等参数也要进行验证。
3 结语
通过对索利那新气相以及液相的相关研究,发现在保证药品生产质量中需要制定合理的指标标准,同时制定出合理的检验方式。通过检验分析,检验的合理性、稳定性、耐用性是检验方法的重点。气相、液相两种方式都是索利那新原料质量标准和检测不可或缺的,可以适应并稳定的用于该种原料药的检验,从而保证原料药的改善,确保最终可以达到要求,对患者的健康用药有一定的保证。另外,需要重点说明一个问题,检测分析方法长期使用稳定性,也是重点关注的问题,需要我们长期的跟踪与研究。